Redoxreaktion Aluminium Und Sauerstoff | Als hinweis erfährst du nur, dass es sich entweder um natrium, um magnesium oder um aluminium handelt. Entscheide anhand der stoffmengen und. Sauerstoff oxidiert das metall und wird dabei selbst reduziert. Aluminium ist hierbei das reduktionsmittel. Abgabe von sauerstoff redoxreaktion am beispiel von der herstellung von eisen (reaktion im hochofen) abgabe von den elektronen aufnahme von den elektronen reaktion zwischen aluminium und brom.
Ein oxidationsmittel ist ein stoff, der den reaktionspartner oxidiert: Um die lösung zu sehen, muss der bereich darunter markiert werden (z.b. Dabei findet die oxidation vom aluminium statt. Da rechts und links des pfeils die gleiche anzahl an elektronen steht, kann man diese in der gesamtgleichung. Bei der teilreaktion der oxidation wird sauerstoff aufgenommen und bei der teilreaktion der reduktion wird sauerstoff abgegeben.

Sauerstoff besitzt normalerweise 6 valenzelektronen (vi. Aluminium ist hierbei das reduktionsmittel. Oxidation mit sauerstoff „diese reaktion mit sauerstoff wird von chemikern als oxidation bezeichnet, erklärt lias und lennarts opa. Eine redoxreaktion ist eine chemische reaktion in dem ein stoff reduziert und ein anderer oxidiert. Für die gesamtgleichung der redoxreaktion werden die teilgleichungen auf jeder seite des reak tionspfeils addiert. Es werden elektronen abgegeben also wird es oxidiert. Auf grund der höheren elektronegativität des sauerstoffs sind die bindungselektronen redoxreaktionen mit elementen: Entscheide anhand der stoffmengen und. Prüfe dein wissen anschließend mit arbeitsblättern und übungen. Hier die verbrennung von magnesium, einmal in luft und danach in reinem sauerstoff, im freien ist die deutlich höhere helligkeit. Die übertragung der elektronen wird als redoxreaktion bezeichnet. Aluminium ist viel unedler als eisen und müsste daher an der luft viel schneller korrodieren. Das hochreaktive gas fluor wird in natronlauge geleitet, dabei entsteht das ebenfalls recht reaktive gas.
Prüfe dein wissen anschließend mit arbeitsblättern und übungen. Für die gesamtgleichung der redoxreaktion werden die teilgleichungen auf jeder seite des reak tionspfeils addiert. Finden diese beiden reaktionen zeitgleich statt, spricht man. Magnesium ist ein brennbares metall und verbrennt heftig mit greller flamme. Aluminium ist viel unedler als eisen und müsste daher an der luft viel schneller korrodieren.
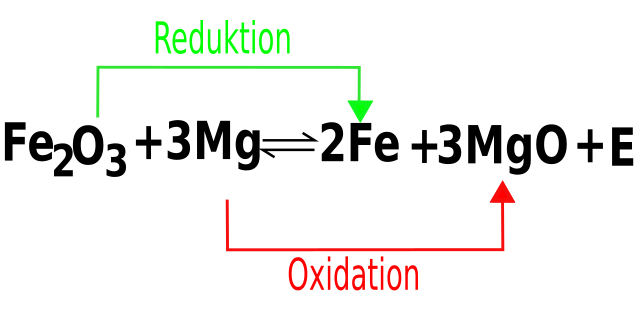
Aluminium ist viel unedler als eisen und müsste daher an der luft viel schneller korrodieren. Vorgehen zum aufstellen der redoxreaktion beispiel genaue chemische definition mit kostenlosem video. Abgabe von sauerstoff redoxreaktion am beispiel von der herstellung von eisen (reaktion im hochofen) abgabe von den elektronen aufnahme von den elektronen reaktion zwischen aluminium und brom. Finden diese beiden reaktionen zeitgleich statt, spricht man. Als eindrucksvolles beispiel einer redoxreaktion wird zu beginn der start eines space shuttle mit der verbrennung von wasserstoff und sauerstoff in den haupttriebwerken gezeigt. 2 o aluminium hat eine höhere reaktionsbereitschaft mit sauerstoff als eisen. Nenne die beiden begriffe, aus denen sich das wort redoxreaktion zusammensetzt. Die redoxreaktion ist eine reaktion mit elektronenübergang. Die reaktion von metallen mit sauerstoff ist eine redoxreaktion, obwohl die metalle immer nur oxidiert und niemals reduziert werden. Die differenz ist also 2 und da sauerstoff als zweiatomiges molekül o2. Als schülerversuche magnesium mit schwefel und magnesium mit sauerstoff umsetzen Im folgenden wird auf einfache weise und überwiegend ohne formeln erklärt, was eine oxidation, eine reduktion und eine redoxreaktion ist und welche bedeutung diese speziellen. Auf dieser seite wird der begriff der redoxreaktion als sauerstoffübertragungsreaktion detailliert erklärt.
Abgabe von sauerstoff redoxreaktion am beispiel von der herstellung von eisen (reaktion im hochofen) abgabe von den elektronen aufnahme von den elektronen reaktion zwischen aluminium und brom. Ein beispiel für eine redoxreaktion sind feuerwerkskörper. Magnesium ist ein brennbares metall und verbrennt heftig mit greller flamme. Aluminium ist hierbei das reduktionsmittel. Das hochreaktive gas fluor wird in natronlauge geleitet, dabei entsteht das ebenfalls recht reaktive gas.

Mit welchem stoff verbindet sich magnesium dabei? Formuliert die oxidation, reduktion, redoxreaktion. Die differenz ist also 2 und da sauerstoff als zweiatomiges molekül o2. Der reaktionspartner, der die elektronen abgibt, (z. Prüfe dein wissen anschließend mit arbeitsblättern und übungen. Eine redoxreaktion ist ein chemisches verfahren bei dem ein reaktionspartner elektronen auf einen anderen überträgt. Finden diese beiden reaktionen zeitgleich statt, spricht man. Dabei wird natrium zunächst in sauerstoff verbrannt (bereits bekannt) und anschließend in chlor. Als eindrucksvolles beispiel einer redoxreaktion wird zu beginn der start eines space shuttle mit der verbrennung von wasserstoff und sauerstoff in den haupttriebwerken gezeigt. Wasserstoff bei reaktion mit sauerstoff). Es werden elektronen abgegeben also wird es oxidiert. Die redoxreaktion soll als eine reaktion mit elektronenübergang verstanden werden. Redoxreaktionen werden in batterien, akkumulatoren, der elektrolyse oder zur herstellung chemischer substanzen verwendet.
Sauerstoff besitzt normalerweise 6 valenzelektronen (vi redoxreaktion. Für die gesamtgleichung der redoxreaktion werden die teilgleichungen auf jeder seite des reak tionspfeils addiert.
Redoxreaktion Aluminium Und Sauerstoff: Abgabe von sauerstoff redoxreaktion am beispiel von der herstellung von eisen (reaktion im hochofen) abgabe von den elektronen aufnahme von den elektronen reaktion zwischen aluminium und brom.
comment 0 Post a Comment
more_vert